Le canola est une importante culture qui sert à la production d’huiles alimentaires et industrielles (figure 1). Les sélectionneurs de canola de Bayer mènent continuellement des recherches pour mettre au point des variétés commerciales qui répondent aux besoins des producteurs et des consommateurs qui utilisent l’huile de canola à des fins alimentaires et industrielles. La figure 2 est une représentation simplifiée du processus de mise au point de variétés. Les sélectionneurs de canola de Bayer ont recours à plusieurs méthodes d’amélioration génétique pour mettre au point de nouveaux produits. Dans cet article, nous présentons les méthodes traditionnelles et les méthodes avancées courantes.

Figure 1. Champ de canola en fleurs.
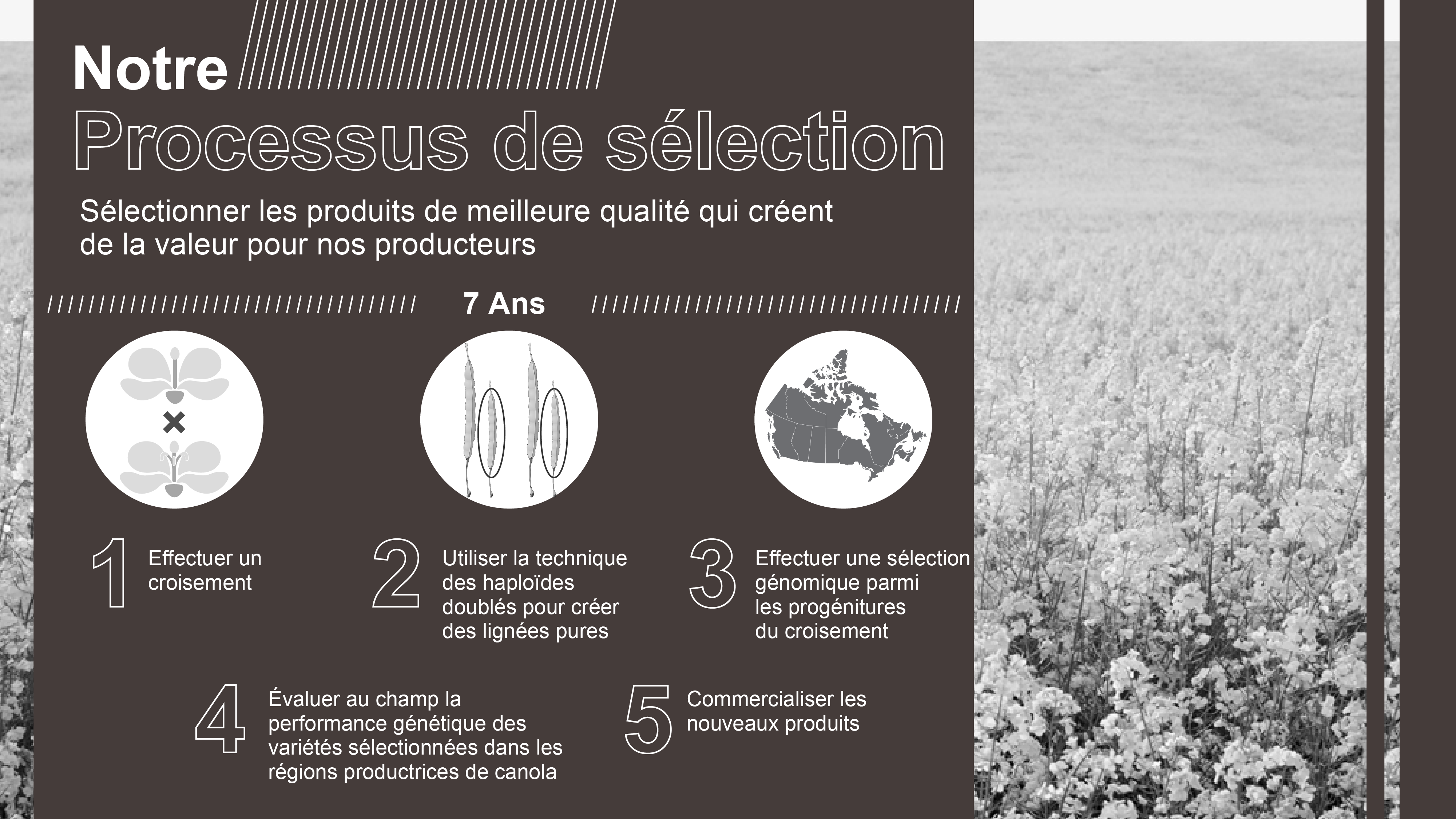
Figure 2. Étapes de la mise au point de produits.
Amélioration génétique du canola
Histoire du canola
Les êtres humains utilisent le colza comme aliment et comme huile à lampe depuis des milliers d’années. Toutefois, l’huile de colza contient des taux élevés d’acide érucique, une molécule qui pose un risque à la santé, et de glucosinolates, qui sont composés sulfurés responsables de la forte saveur amère des radis, de la moutarde et d’autres légumes1.
Durant les années 1960 et 1970, des sélectionneurs de colza de la Saskatchewan et du Manitoba ont commencé à faire des croisements de colza afin de créer des variétés dont l’huile est de meilleure qualité pour la consommation humaine1. De 10 à 20 ans plus tard, leurs efforts ont porté fruit et des variétés commerciales de colza qui contiennent une huile alimentaire ayant des caractéristiques souhaitables pour la consommation humaine ont vu le jour (figure 3). Pour différencier ces nouveaux produits améliorés des variétés traditionnelles de colza, le Conseil canadien du canola a déposé le nom « canola » comme marque de commerce1. L’huile de canola doit contenir moins de 2 % d’acide érucique et les graines doivent contenir moins de 18 µmol de glucosinolates par gramme de farine séchée à l’air et exempte d’huile1.
La mise au point de variétés de canola a évolué, passant de la pollinisation libre à l’hybridation à l’aide de méthodes traditionnelles et génomiques. Les principales méthodes utilisées de nos jours comprennent la sélection par croisement, la sélection par mutation et la sélection génomique2. La pollinisation libre consistait simplement à planter des semences conservées de la récolte précédente.
Hybridation
Les méthodes traditionnelles de sélection par croisement consistent à sélectionner différentes plantes qui ont des caractéristiques souhaitables (comme une huile de qualité, la résistance à la verse, la résistance aux maladies, un potentiel de rendement élevé) et de les croiser entre elles dans l’espoir que ces caractères seront transmis à la progéniture de l’une d’entre elles. Pour ce faire, le sélectionneur détermine quelle plante sera utilisée comme parent mâle et quelle plante sera utilisée comme parent femelle en fonction des caractéristiques recherchées. Il doit alors enlever les étamines, ou organes mâles, de la plante choisie comme étant le parent femelle. Il prélève ensuite du pollen du parent mâle pour polliniser le pistil (organe femelle) du parent femelle. Les semences produites par le parent femelle seront récoltées et semées et ce processus est répété sur plusieurs générations (appelées générations F1, F2, F3 et ainsi de suite) afin de produire une lignée homozygote, ou lignée pure, aux caractéristiques voulues (ce qui prend environ sept générations). Cette plante homozygote peut alors être croisée avec une autre plante homozygote mise au point par le même processus afin d’obtenir une plante hybride aux caractéristiques voulues. Ce processus peut être repris sur des milliers de plantes pour mettre au point des variétés prometteuses. Ces variétés font ensuite l’objet de nombreux essais pour déterminer celles qui sont les meilleures candidates à la commercialisation. Du début à la fin, ce processus prend plusieurs années.
Cette méthode de sélection traditionnelle peut être renforcée par la sélection par mutation. Des mutations surviennent naturellement dans les populations, mais elles peuvent également être provoquées par radiation, par des composés chimiques, par des moyens physiques et par des agents biologiques. Certaines mutations peuvent présenter des caractéristiques intéressantes, lesquelles peuvent être introduites dans d’autres plantes par rétrocroisement traditionnel.
Les méthodes de sélection par croisement continuent d’être utiles à la mise au point de nouvelles variétés. Toutefois, les variétés améliorées ainsi peuvent avoir des caractéristiques recherchées comme un potentiel de rendement élevé, mais avoir perdu une résistance aux maladies ou à la verse ou d’autres caractéristiques souhaitables pendant le processus de développement. C’est là que le génie moléculaire peut aider.

Figure 3. L’huile des graines de canola peut être utilisée pour la cuisson et à des fins industrielles.
Sélection moléculaire
Le séquençage du génome et des gènes d’ADN (acide désoxyribonucléique) est une technique que les sélectionneurs peuvent utiliser pour sélectionner rapidement et efficacement les meilleures plantes homozygotes pour l’hybridation. Grâce au séquençage de l’ADN, les sélectionneurs sont en mesure de déterminer si les graines d’une plante homozygote possèdent les caractéristiques voulues sans avoir à les faire pousser. Si l’ADN de l’homozygote ne contient pas les gènes des caractéristiques voulues, l’homozygote peut être éliminé. La génomique est particulièrement utile à la mise au moins de variétés résistantes aux herbicides.
CRISPR
Depuis une dizaine d’années, la technologie CRISPR (« courtes répétitions palindromiques groupées et régulièrement espacées ») est devenue une méthode de mise au point de variétés de canola et d’autres cultures dotées de caractéristiques avantageuses (palindromique signifie que le segment de la molécule d’ADN comprend deux séquences successives qui sont symétriques l’une par rapport à l’autre au point central). CRISPR est une zone spécialisée de l’ADN d’une bactérie qui contient des nucléotides répétés (qu’on peut imaginer comme les barreaux d’une échelle) et qui sont régulièrement espacés par des séquences appelées « spacers » (qui seraient les montants de l’échelle). Les nucléotides répétés sont les éléments structuraux de l’ADN3. Les spacers entre les répétitions sont des copies de parties de virus qui ont déjà infecté la bactérie et dont la bactérie se sert pour reconnaître les virus. Les bactéries produisent un enzyme, Cas9, qui peut cliver l’ADN. Lorsqu’un virus attaque la bactérie, la bactérie envoie l’enzyme Cas9 vers le virus pour qu’elle le clive, ce qui le désactive4.
Le mécanisme CRISPER/Cas9 peut être utilisé pour modifier l’ADN en désactivant ou en réparant un gène ou en insérant une séquence d’ADN dans le gène où Cas9 a clivé l’ADN3,4. Cette procédure se fait au laboratoire où un chercheur utilise de l’ARN (une molécule capable de décoder l’information génétique de l’ADN) pour localiser l’endroit dans le noyau de la cellule où la modification doit être faite4. Dans le cas des plantes, l’endroit où la modification doit être fait peut être, par exemple, le gène qui contrôle la résistance à la verse. Supposons que le sélectionneur a déterminé qu’une plante homozygote de canola possède les caractéristiques souhaitées en matière de potentiel de rendement et de résistance aux maladies, mais que sa résistance à la verse est médiocre. Un technicien de laboratoire peut alors cliver le gène de sensibilité à la verse dans une plante de cette lignée à l’aide de Cas9 et insérer à cet endroit un gène conférant une meilleure résistance à la verse d’un autre plant de canola. La plante modifiée possède alors les caractéristiques recherchées et le sélectionneur peut alors la croiser avec une autre plante homozygote pour créer une nouvelle variété. Les transformations CRISPR sont très transmissibles à la progéniture; c’est pourquoi elles permettent de réduire le temps nécessaire pour mettre au point de nouvelles variétés3,4.
Pour visualiser CRISPR, imaginez de nouveau une échelle de bois. Entre chaque barreau, il y a des montants de chaque côté de l’échelle. Imaginez maintenant qu’un de ces montants est pourri. L’échelle est généralement en bon état, sauf pour ce montant. En bon bûcheron, vous sciez (coupez à l’aide de Cas9) le montant pourri et y insérez un montant neuf de la même essence de bois que vous attachez solidement. La pièce insérée a une apparence différente; toutefois, comme elle provient de la même essence de bois, elle possède le même code génétique que le montant enlevé. L’échelle est maintenant réparée et peut être de nouveau utilisée.
Technique des haploïdes doublés
La technique des haploïdes doublés (figure 4) est autre méthode pour mettre au point de nouvelles variétés de canola. Une plante est dite haploïde si elle possède qu’un seul jeu de chromosomes alors qu’une plante haploïde doublée, ou dihaploïde, est une plante qui est homozygote à 100 %, ayant deux exemplaires identiques de chaque chromosome. La technique des haploïdes doublés permet aux sélectionneurs de créer des lignées parentales homozygotes à partir de plantes hétérozygotes en une seule génération, ce qui réduit considérablement le temps nécessaire pour mettre au point de nouvelles variétés. Les plantes haploïdes doublées sont créées à partir des grains de pollen immatures (microspores) dont les chromosomes sont doublés artificiellement pour produire des plantes diploïdes homozygotes5. Les microspores des bourgeons floraux des plantes F1 sont utilisées pour produire des plantes haploïdes doublées6. Et comme chaque microspore produit une plante au bagage génétique différent des autres, des milliers de plantes différentes peuvent être obtenues et évaluées grâce au séquençage de l’ADN pour déterminer si elles possèdent les caractéristiques voulues dès la première génération.
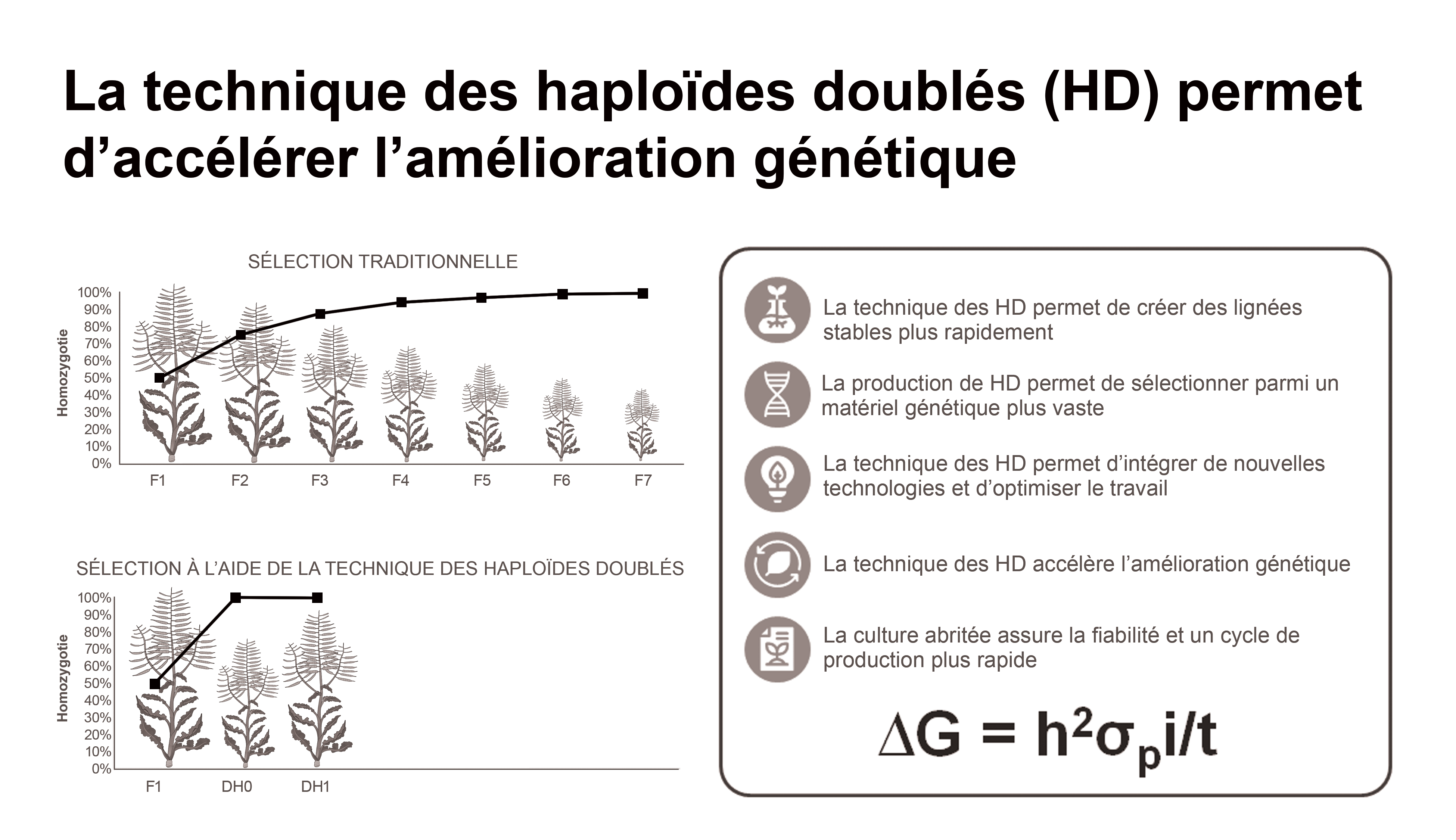
Figure 4. La sélection à l’aide de la technique des haploïdes doublés permet d’accélérer l’amélioration génétique.
L’amélioration génétique continuer d’évoluer et Bayer est un leader dans le développement et l’utilisation de nouvelles méthodes de sélection. La figure 5 donne un aperçu de l’évolution des méthodes utilisées par Bayer jusqu’à la sélection de précision, laquelle est fondée sur les besoins des clients pour des variétés qui sont, entre autres, productives, résistantes, robustes et dont les graines contiennent un taux élevé d’huile de bonne qualité.
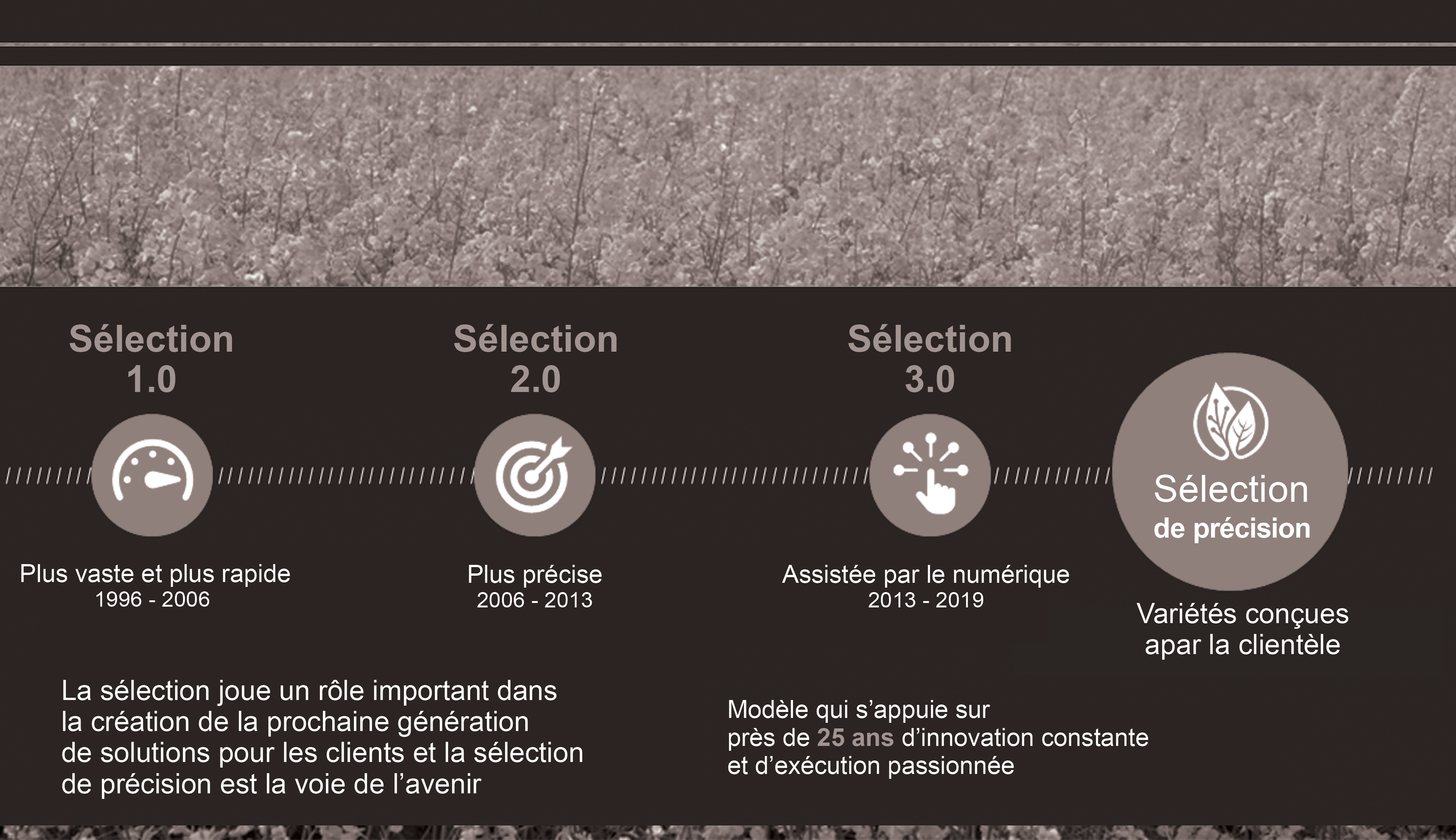
Figure 5. Évolution des méthodes de sélection de précision à Bayer Crop Science.
Sources :
1Casséus, L. 2009. Le canola : un cas de réussite au Canada. Un coup d’œil sur l’agriculture canadienne. Statistique Canada. Catalogue no. 96-325-X.
2Ahmar, S., Gill, R.A., Jung, K., Faheem, A., Qasim, M.U., Mubeen, M., et Zhou, W. 2020. Conventional and molecular techniques from simple breeding to speed breeding in crop plants: recent advances and future outlook. International Journal of Molecular Sciences. Int. J. Mol. Sci. 2020, 21, 2590.
3Vidyasagar, A. 2018. What is CRISPER? LIVESCIENCE. https://www.livescience.com/58790-crispr-explained.html#:~:text=CRISPR%20technology%20is%20a%20simple,of%20diseases%20and%20improving%20crops.
4Saey, T.H. 2017. Explainer: How CRISPR works. ScienceNewsforStudents. https://www.sciencenewsforstudents.org/article/explainer-how-crispr-works.
5Khan, T.N. et Croser, J.S. 2004. Double haploid production. PEA Overview. Encyclopedia of Grain Science. https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/doubled-haploids.
6Burbulis, N. et Kott, L.S. 2013. Application of doubled haploid technology in breeding of Brassica napus. 10.3 Doubled haploid method in breeding of Brassica napus. From Plant Genomics to Plant Biotechnology. Woodhead Publishing Series in Biomedicine. https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/doubled-haploids
Autres sources:
Rowe, T. 2019. CRISPR in plant breeding. Creative Components. 238. Iowa State University. https://lib.dr.iastate.edu/creativecomponents/238.
Oplinger, E.S., Hardman, L.L., Gritton, E.T., Doll, J.D., et Kelling, K.A. 1989. Canola (Rapeseed) Alternative Field Crops Manual. Universities of Wisconsin and Minnesota. Accessed through Purdue University Center for New Crops & Plant Products. https://hort.purdue.edu/newcrop/afcm/canola.html.
Sites Web vérifiés le 15 octobre 2021
Avis juridique
La performance peut varier d’un endroit à l’autre et d’une année à l’autre, compte tenu des variations locales dans les conditions de croissance, de sol et de climat. Si possible, les producteurs devraient évaluer les résultats de plusieurs sites et années et devraient tenir compte des conséquences de ces conditions sur leurs champs.
Bayer et La Croix Bayer sont des marques déposées de Bayer Group. Utilisation sous licence. Toutes les autres marques de commerce appartiennent à leur titulaire respectif. ©2022 Groupe Bayer. Tous droits réservés. 2014_25166